보관검체와 참조검체의 차이, 보관기간 및 샘플 수량까지 완벽 정리
제약회사에서 출하 후 제품의 품질을 다시 확인할 수 있도록
제품 시료를 일정 기간 보관하는 제도가 바로 **보관검체(Retained Sample)**와 **참조검체(Reference Sample)**입니다.
두 용어는 비슷해 보이지만, 용도, 보관 방식, 규정 기준이 서로 다르며,
실사에서도 정확한 구분과 관리가 요구됩니다.
이번 글에서는 보관검체와 참조검체의 차이를 명확히 설명하고,
GMP 기준에 따른 보관기간, 샘플 수량, 실사 지적사항까지 상세히 정리해보겠습니다.

1. 보관검체 vs 참조검체 차이점

국내에서는 대부분 보관검체 개념으로 통합 관리하지만,
수출 제품이나 해외 인증 대응 시에는 참조검체 개념을 별도로 운용하는 사례도 있습니다.
2. 보관기간 기준
📌 기준 근거: 「의약품 제조 및 품질관리 기준 고시」 제112조

냉장 보관 품목, 단기 유효기간 제품은 회사 SOP에 따라 조정이 가능하며,
모든 기준은 근거 자료에 따라 설정되어야 합니다.
3. 보관검체 샘플 수량 기준
GMP에서는 구체적인 수량을 고시하고 있지는 않지만,
공통적으로 재시험이 가능한 최소 수량 이상을 보관할 것을 요구하고 있습니다.
제형 구분 없이, 통상적으로 2회 시험 가능한 분량을 확보하는 것이 일반적입니다.
시험 항목 수, 분석 방법, 제형 특성에 따라 회사별 SOP 기준이 별도로 정의되어야 하며,
실제 시험 가능 여부가 핵심 평가 기준이 됩니다.
4. 보관 조건 및 표시사항

일부 실사에서는 보관검체 구역의 물리적 분리 여부,
외부표시 라벨의 식별성까지 확인하기 때문에
시각적으로 명확하게 표시해두는 것이 바람직합니다.
5. 실사에서 자주 지적되는 사례
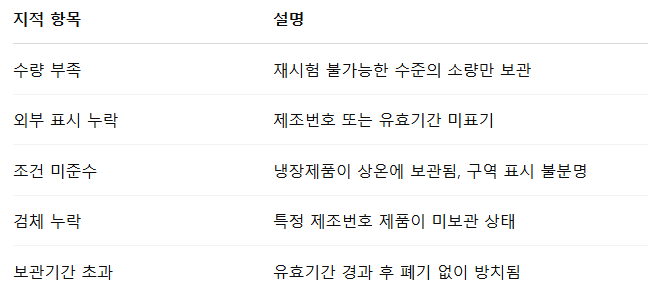
실사에서는 보관검체 보관표, 배치번호별 기록, 점검이력까지 함께 확인하는 경우가 많습니다.
핵심 요약
보관검체는 품질 문제 발생 시 재시험을 위한 시료,
참조검체는 유통 제품의 법적 증거 확보용 시료입니다.
보관검체는 유효기간 + 1년 이상 보관해야 하며,
수량은 2회 시험 가능한 분량 이상 확보하는 것이 일반적입니다.
확한 표시, 전용 보관공간, 보관조건 유지가 실사 대응의 핵심입니다.
결론
보관검체는 단순히 제품을 남겨두는 것이 아니라,
출하 품질을 다시 증명할 수 있는 최후의 품질 보증 수단입니다.
관리 기준이 불명확하거나 수량이 부족한 경우,
실사 지적뿐 아니라 민원 또는 회수 시 품질 대응에 실패할 수 있습니다.
검체 하나도 GMP 시스템의 일부라는 인식으로,
정확한 기준, 조건, 수량을 갖추는 것이
품질관리의 기본이며 실사 대비의 시작입니다.
'제약회사 정보' 카테고리의 다른 글
| 제약회사 자재 파트 업무 정리 – GMP 실무 흐름과 실사 대응 포인트까지 (0) | 2025.04.19 |
|---|---|
| HPLC 컬럼 관리 방법 – 제약회사 QC 실무자를 위한 보관, 세척, 기록 가이드 (0) | 2025.04.18 |
| 제약회사 타정 공정별 IPC 항목 정리 – 실무자가 반드시 점검해야 할 기준 (0) | 2025.04.16 |
| 제약회사 연간품질평가(APQR)란? 실무자를 위한 보고서 작성법 총정리 (0) | 2025.04.15 |
| GMP 실사 대응 – 실사관이 자주 묻는 질문 15선 (0) | 2025.04.14 |



