제약회사 적격성 평가(Qualification), DQ부터 PQ까지 실무자 시선으로 정리
설비를 도입했다고 해서 바로 사용할 수 있을까요?
GMP 환경에서는 설비나 시스템이 의도한 목적대로, 품질에 영향을 주지 않고 작동하는지를
사전에 문서로 입증해야 합니다.
이 과정을 우리는 **적격성 평가(Qualification)**라고 부릅니다.
오늘은 적격성 평가의 개념부터 절차, 실무 포인트까지 정리해봅니다.
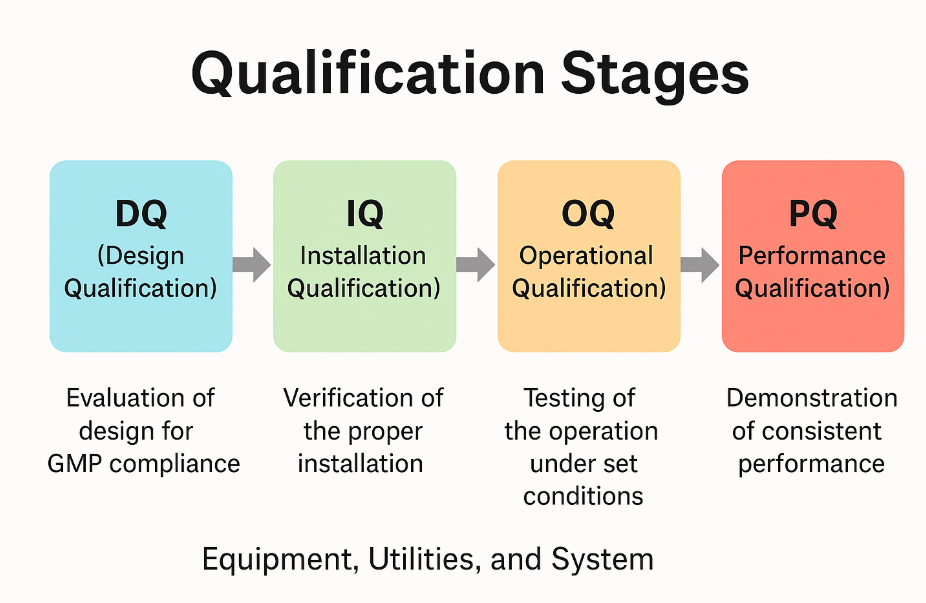
적격성 평가(Qualification)란?
적격성 평가는 설비, 유틸리티, 시스템이 GMP 기준에 따라 제대로 작동하는지 단계적으로 확인하는 절차입니다.
기계가 '돌아간다'가 아니라, 정해진 조건에서 원하는 결과를 지속적으로 내는가를 검증하는 것이죠.
적격성 평가가 중요한가?
GMP에서는 설비, 장비, 시스템이 품질에 영향을 줄 수 있는 요소로 분류됩니다.
적격성 평가는 설비 사용 전 확인 절차로, 추후 문제 발생 시 책임소재를 명확히 하기 위해 필요합니다.
실사 시 반드시 확인받는 항목 중 하나이며, 문서 누락이나 단계 생략은 지적 대상이 됩니다.
또한, 적격성 평가 없이 수행한 밸리데이션은 무효로 간주될 수 있으므로,
공정 밸리데이션의 시작은 적격성 평가로부터입니다.
적격성 평가의 4단계 구성
1. DQ (Design Qualification) – 설계 적격성 평가
설비나 시스템의 설계가 GMP 요건에 적합한지 평가합니다.
재질, 구조, 청소 용이성, 유지보수 접근성 등을 미리 검토해야 합니다.
예: 정제 코팅기의 경우, 균일한 코팅 분포 가능 여부, 세척 구조 확인 등
2. IQ (Installation Qualification) – 설치 적격성 평가
실제 설치가 설계 및 제조사 매뉴얼과 일치하는지 확인합니다.
전원 연결, 유틸리티 배관, 설치 위치, 부품 확인, 교정 등 포함
예: 혼합기 설치 후 전압 확인, 고정 상태, Level 조정, 설비 이력 확인
3. OQ (Operational Qualification) – 운전 적격성 평가
설정된 조건에서 기능이 정상 작동하는지 시험합니다.
버튼, 알람, 인터락, RPM, 압력, 온도, 타이머 등 동작 여부 확인
예: 정제기의 압력 조절, 인터락 오작동 방지 장치 작동 여부 테스트
4. PQ (Performance Qualification) – 성능 적격성 평가
실제 사용 조건에서 일관된 결과가 나오는지를 평가합니다.
GMP 기준에서는 실제 제조 조건 하에 3배치 이상 반복 시험을 수행하며,
시험결과의 일관성과 적합성을 입증해야 PQ 완료로 인정됩니다.
예: 타정기 운전 조건 50rpm, 10kN 설정 → 함량 균일도, 경도, 붕해 결과 모두 적합
실무에서 주의할 점
적격성 평가와 밸리데이션은 연결된 과정입니다.
→ Qualification 없이는 공정 Validation 의미 없음.
모든 단계는 문서화가 핵심입니다.
로그, 사진, 시험결과, 서명 등 기록이 남아야 추적 가능.
변경관리와의 연계 중요
→ 설비 교체, 핵심 부품 변경, 제어 시스템 수정 시 Change Control과 함께 적격성 재평가 여부 판단 필요.
실사 대응 포인트
설비별 DQ, IQ, OQ, PQ 문서 존재 여부
각 단계별 승인 서명, 평가 근거, 판단 기준 확인
실제 제조 조건과 PQ 평가 조건이 일치하는지 확인
변경 이력 연계 및 재평가 수행 여부
교육 이력, 사용 허가 전 도입 시기 등 검토됨
마무리
적격성 평가는 GMP의 기본 중 기본입니다.
문제가 없는 설비를 사용하는 게 아니라, 문제 없다는 걸 입증해야 사용할 수 있는 환경이 바로 제약산업이죠.
설비의 신뢰성은 문서로 증명해야 하며,
그 증명의 출발점이 바로 DQ, IQ, OQ, PQ 4단계 평가입니다.
“아무 문제 없었어요”는 근거가 아닙니다.
“문서화된 적격성 평가 결과로 증명됩니다”가 GMP의 언어입니다.
※ 이 글은 제약회사 실무 경험과 GMP 기준을 바탕으로 정리한 내용이며,
회사별 SOP에 따라 평가 범위나 적용 기준은 달라질 수 있습니다.
2025.04.08 - [제약회사 정보] - 제약회사 Audit(감사) 대응, 실무에서 꼭 알아야 할 기본과 전략
'제약회사 정보' 카테고리의 다른 글
| 제약회사 실무 – Change Control vs CAPA, 둘은 어떻게 다르고 연결되는가? (1) | 2025.04.12 |
|---|---|
| 제약회사 Data Integrity(DI), 실무자가 짚어주는 ALCOA+ 원칙과 실사 대응 전략 (1) | 2025.04.11 |
| 제약회사 실무자가 정리한 OOS, OOT 개념과 처리 절차 (0) | 2025.04.09 |
| 시험방법 밸리데이션이란 무엇일까? (0) | 2025.04.08 |
| 장기시험 중 결과 이상(OOT, OOS) 발생 시 처리 절차 (0) | 2025.04.08 |



